有關mRNA疫苗在感染性疾病的研究進展

以mRNA為基礎的治療代表了一個相對新穎和高效的藥物類別。近發表的幾項研究強調了mRNA疫苗在治療不同類型的惡性腫瘤和傳染病方面的潛在療效,這些疾病中傳統的疫苗策略不能引起保護性免疫反應。
傳染病疫苗是目前mRNA療法中領先的應用。目前正在進行臨床前試驗和臨床使用的大多數mRNA疫苗都是以單次給藥的形式注射到皮膚、肌肉或皮下,在那里它們被免疫或非免疫細胞吸收并轉化為抗原,展示給T細胞和B細胞。
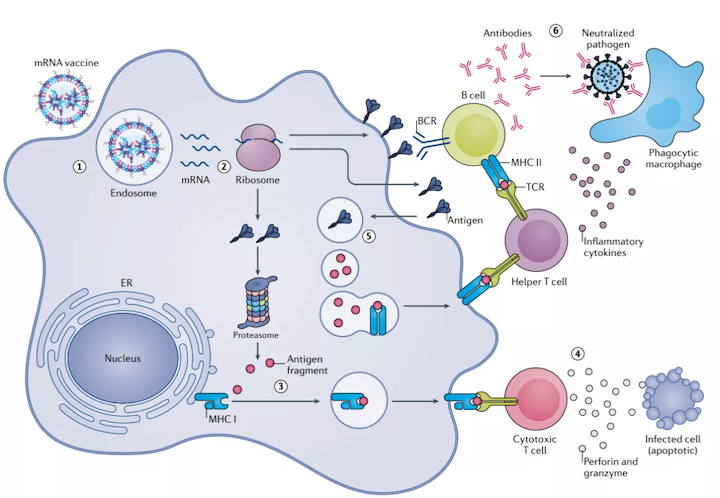
截至2019年底,15種針對傳染病的候選mRNA疫苗已進入臨床試驗,當時,人們認為mRNA疫苗至少還需要5-6年才能獲得監管部門的批準。但是,當2020年初COVID-19大流行橫行時,這些期望就被顛覆了。在接下來的幾個月里,mRNA疫苗的研發、制造和部署都進入了飛速跨越的階段。
SARS-CoV-2疫苗
大多數SARS-CoV-2候選疫苗對病毒表面的棘突蛋白產生免疫反應。棘突蛋白與其宿主細胞表面的受體血管緊張素轉換酶2結合。然后,細胞的跨膜絲氨酸蛋白酶2將附著的棘突蛋白切開,該蛋白酶誘導構象變化,暴露棘突蛋白的融合肽并促進與細胞或內體膜的融合。通常,疫苗mRNA編碼的抗原要么是全長棘突蛋白,要么是棘突蛋白的受體結合域。
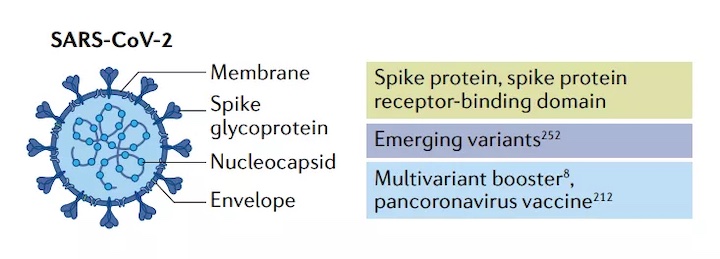
截至2021年6月18日,185個CVID-19疫苗候選處于臨床前開發階段,另外102個已進入臨床試驗。在臨床試驗中,19種為mRNA疫苗。2020年12月11日,輝瑞的BNT162b2疫苗獲得了FDA的緊急授權,成為個獲準用于人體的mRNA藥物。一周后,Moderna疫苗mRNA-1273也被授權在美國使用。終,它們是批在美國、英國、加拿大和其他幾個獲得授權的SARS-CoV-2疫苗。
輝瑞和BioNTech共同開發了五種mRNA候選疫苗,它們編碼棘突蛋白抗原的變體。兩個主要候選藥物BNT162b1和BNT162b2使用Acuitas Therapeutics的可電離脂質ALC-0315和核苷修飾的mRNA,其中所有尿苷被N1甲基假尿苷取代,以增強mRNA翻譯。BNT162b1編碼三聚體分泌型棘突蛋白的受體結合域,而BNT162b2編碼全長SARS-CoV-2棘突糖蛋白,S2亞基中有兩個脯氨酸替換,將蛋白鎖定在融合前構象。
在兩種疫苗的階段試驗中,都可誘導高滴度的中和抗體,并產生強烈的CD4+和CD8+反應,伴有輕度至中度不良反應。兩種候選疫苗耐受性良好且有效,但只有BNT162b2疫苗因其較輕的全身和局部不良反應而進入II/III期試驗。在第三階段試驗中,BNT162B2顯示了95%的整體預防和90~100%的療效。
Moderna與國立衛生研究院合作開發了mRNA-1273。該疫苗使用了可電離脂質SM-102制備LNP,該LNP封裝N1甲基假尿苷修飾的mRNA。該序列編碼SARS-CoV-2棘突蛋白,帶有兩個脯氨酸替換,賦予融合前構象。
在1期臨床試驗中, mRNA-1273非常有效且耐受性良好。在涉及30420名志愿者的III期試驗中,兩支100μg劑量疫苗的預防率為94.1%,注射部位的局部疼痛是常見的副作用。第二次給藥后,一半的志愿者報告了中度至重度系統性副作用(例如疲勞、肌肉疼痛、關節疼痛),這些副作用在48小時內消失。
盡管輝瑞和Moderna公司生產的疫苗已證明具有良好的療效和安全性,但它們對冷鏈儲存的需求帶來了保障的巨大困難。mRNA-1273可在4-8℃下儲存持續一個月,而BNT162b2則需要在-60℃條件下儲存。
CureVac的候選疫苗CVnCoV在5℃下可穩定儲存3個月。CVnCoV使用Acuitas Therapeutics(可能是ALC-0315)的可電離脂質和編碼具有兩個脯氨酸替代物的全長棘突蛋白的未修飾mRNA。在階段臨床試驗中,志愿者產生的中和抗體與CVID-19恢復期患者相似,耐受性良好。然而不幸的是,在包括4萬人的III期臨床試驗中,CVnCoV僅顯示出47%的療效。中期分析表明,CVnCoV的較低療效歸因于新出現的SARS-CoV-2變異。
目前,CureVac正與GSK合作,開發第二代候選藥物——CV2CoV,該藥物經過優化,以增強相對于CVnCoV的翻譯和免疫原性。CV2CoV使用來自人類羥基類固醇17-β-脫氫酶4基因的5′UTR和來自人類蛋白酶體20S亞單位β3基因的3′UTR。在臨床前研究中,CV2CoV在體外顯示出比CVnCoV高1.8倍的蛋白表達,并在大鼠中誘導針對B.1.1.7、B.1.1.298和B.1.351變體的高滴度交叉中和抗體。
另一種耐熱候選疫苗ARCoV由中國人民解放軍軍事科學院與Walvax生物技術公司合作開發,可以在25℃穩定一周。ARCoV編碼棘突蛋白的受體結合域。在臨床前研究中,在食蟹猴中可誘導高SARS-CoV-2特異性IgG抗體和強病毒中和滴度。盡管CVnCoV和ARCoV熱穩定性背后的原因尚不清楚,但mRNA二級結構、較小的mRNA大小、GC含量和脂質可能是重要因素。
其它一些mRNA候選疫苗也正在研制中。LNP-nCoVsaRNA由倫敦帝國理工學院和Acuitas Therapeutics合作開發,編碼全長棘突蛋白。目前,正在使用0.1–1?g劑量遞增方案進行I期臨床試驗評估(ISRCTN17072692),其使用了所有候選mRNA疫苗中低的RNA劑量。
另一種自擴增mRNA疫苗候選物ARCT-021(也稱為LUNAR-COV19)由Arcturus公司利用其專有的LUNAR脂質載體和自轉錄和復制RNA(STARR)平臺開發。它編碼全長融合前棘突蛋白。
流感病毒疫苗
全每年約有29萬至65萬人死于流感病毒。目前的疫苗以促進病毒進入的病毒血凝素蛋白為靶標。傳統的流感疫苗是生長在雞蛋中的滅活流感病毒,生產時間長,純化困難。此外,病毒會在雞蛋中發生變異以獲得佳生長,有時會使它們在人類中無效。

因此,確實需要替代的抗原靶點和生產方法。體外轉錄的合成mRNAs可以滿足這一需求,并確保在出現全新流感毒株時快速生產疫苗。例如,2013年,基于LNP(DLinDMA)的自我擴增mRNA疫苗在中國H7N9爆發后8天內迅速研制成功,然而不幸的是,由于當時沒有用于mRNA制造的GMP設施,未能進行臨床試驗。
也有人致力于研制一種不需要每年修改的通用流感疫苗。這種疫苗可以對幾種流感病毒株和亞型產生免疫力。在2012年首次展示的流感mRNA疫苗,三次皮內注射在小鼠中分別誘導針對H1N1和H5N1毒株的同源和異源免疫。
值得注意的是,不易發生突變的血凝素保守柄區近已成為一種新型通用疫苗靶標。還有另一項研究使用LNPs來遞送50ng劑量的mRNA,編碼三種保守的流感蛋白:神經氨酸酶、核蛋白和基質-2離子通道蛋白以及血凝素柄區。令人難以置信的是,這種微小的mRNA劑量產生了廣泛的保護性抗體。
寨卡病毒疫苗
寨卡病毒感染于1947年首次被發現,感染寨卡病毒的患者通常無癥狀或出現發熱、皮疹和肌肉疼痛等輕微癥狀。然而,寨卡病毒在2015-2016年美洲流行期間成為全球健康危機,該病毒在懷孕期間導致嚴重胎兒神經畸形和胎兒死亡。膜和包膜蛋白(prM-E)是針對寨卡病毒的mRNA疫苗常見的抗原選擇,因為針對prM-E的中和抗體可以防止病毒融合。
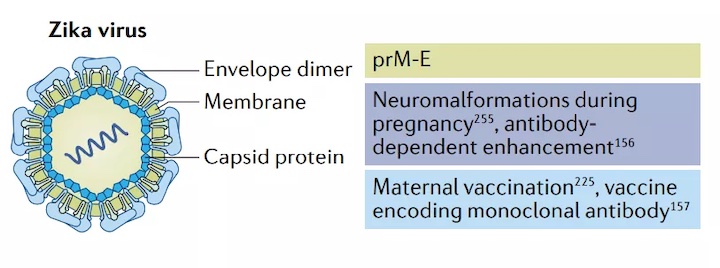
Moderna與華盛頓大學醫學院合作,開發了一種改良的prM-E mRNA,其中包含E蛋白中的突變融合環形表位。兩個10?g劑量的mRNA可保護小鼠免受寨卡病毒攻擊,并減少登革熱增強抗體的產生。這些令人鼓舞的臨床前結果促進了I期試驗的進行,中期結果表明,疫苗mRNA-1893在10天內誘導94-100%的血清轉陽,耐受性良好。
此外,另一項研究使用被動免疫方法,利用基于角鯊烯的納米載體遞送編碼ZIKV中和抗體的mRNA。對于免疫系統受損而無法合成自身抗體的免疫缺陷患者來說,這是一種很有吸引力的方法。
HIV病毒疫苗
全球范圍內,艾滋病毒目前影響3800萬人,預計到2030年將影響多達4200萬人。盡管已進行了30年的研究,但尚未開發出有效的疫苗,這主要是因為HIV包膜蛋白具有顯著的抗原性多樣性以及隱藏關鍵包膜蛋白表位“聚糖屏障”。幾項臨床前研究已經使用了多種載體,包括陽離子納米乳劑、DOTAP/DOPE脂質體、Polymers和可電離LNP,它們在不同程度看到了一些效果。這些研究表明,除了有效的載體外,新的抗原對于有效地靶向HIV是非常關鍵的。

呼吸道合胞病毒疫苗
呼吸道合胞病毒是全球急性下呼吸道感染的主要原因。每年,估計有60000名5歲以下兒童死亡,超過14000名65歲以上的人死亡。

目前的RSV候選疫苗主要針對高度保守的F蛋白。盡管一些候選者由于中和抗體滴度不足而未能通過臨床試驗,但對F蛋白構象的新發現表明,針對融合前構象接種疫苗可產生優異的中和抗體反應。這一發現有望改進未來的疫苗設計。
Moderna正在評估編碼融合前F蛋白的三種單劑量候選疫苗:mRNA-1172和mRNA-1777用于成人,以及mRNA-1345用于兒童。在I期臨床試驗中,mRNA-1777誘導RSV中和抗體產生強烈的體液反應,CD4+T細胞對RSV F蛋白產生反應,且無嚴重不良事件。mRNA-1345的序列已被進一步設計和密碼子優化,以增強相對于mRNA-1777的翻譯和免疫原性。接種后1個月,mRNA-1345產生的中和抗體滴度約為mRNA-1777的八倍。終,Moderna的目標是將mRNA-1345與其兒科人類偏肺病毒/副流感病毒3型(hMPV/PIV3)候選疫苗mRNA-1653整合,并用單一配方為兒童接種針對三種不同病原體的疫苗。
埃博拉病毒疫苗
埃博拉病毒(EBOV)于1976年首次被確定為導致埃博拉病爆發的病原體。這種病毒性出血熱在2014-2016年西非埃博拉疫情中奪走了11000多條生命。2019年,FDA批準了一種基于重組水泡性口炎病毒(VSV)的埃博拉疫苗(rVSV-EBOV)。盡管與未接種疫苗相比,rVSV-EBOV在預防埃博拉傳播方面的有效性為97.5%,但臨床試驗注意到一些安全問題(例如急性關節炎和皮疹)。

抗EBOV的mRNA疫苗可能比這種基于病毒的疫苗更安全,因為它們不會在體內復制。一種編碼EBOV糖蛋白的mRNA疫苗已在小鼠中證明了效力。該疫苗通過CD8+和CD4+T細胞誘導糖蛋白特異性IgG抗體和IFN-γ以及IL-2的強烈表達,可保護動物免受致命病毒的傷害。
狂犬病毒疫苗
狂犬病是一種人畜共患病,以神經癥狀為特征,死亡率近100%。盡管已有疫苗獲批,但每年仍有5萬多人死于狂犬病,這突出表明需要更有效、更廉價的疫苗。
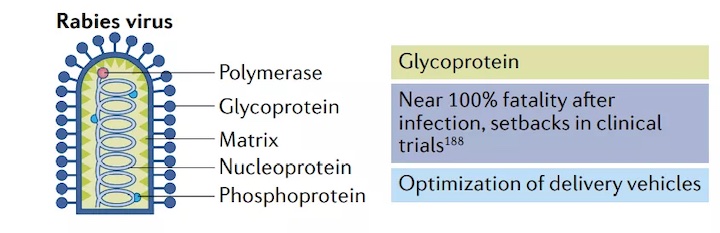
為了滿足這一需求,CureVac利用其RNActive平臺,篩選出編碼狂犬病病毒糖蛋白的未經修飾的mRNA疫苗CV7201。在一項臨床前研究中,CV7201可誘導小鼠和豬的高中和抗體滴度,并誘發抗原特異性CD4+和CD8+T細胞反應。但是在I期臨床試驗中發現,雖然給藥途徑不影響免疫反應,但給藥裝置只有皮內注射器產生短暫的體液免疫反應。這種弱的給藥效果以及高發生率的不良事件表明需要進一步優化給藥平臺。
隨后,CureVac使用Acuitas Therapeutics生產的專有LNP作為其新疫苗CV7202的載體。在一項臨床前研究中,CV7202誘導產生強抗體滴度和CD8+和CD4+T細胞反應。I期臨床試驗結果表明,兩個1?g劑量可產生高滴度中和抗體以及強適應性免疫反應,耐受性良好。
瘧原蟲疫苗
盡管開發中的絕大多數mRNA疫苗是為了防止病毒感染,但也有預防其他傳染病的努力。瘧疾是由單細胞真核寄生蟲引起的,其發病率和殺傷力位居榜首。每年,瘧疾折磨著全2億多人,奪走40多萬患者的生命。由于缺乏表面抗原和瘧原蟲的復雜生命周期,抗瘧疫苗的生產一直很困難。幸運的是,人體對瘧原蟲感染的自然免疫反應的研究已經確定了潛在的非表面抗原靶點。
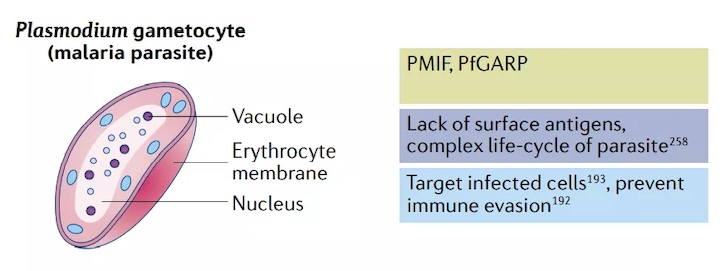
例如,瘧原蟲分泌的細胞因子巨噬細胞遷移抑制因子(PMIF)已被證明可阻止T細胞產生長期記憶。根據這一發現,從基于角鯊烯的陽離子納米乳劑中制備了一種疫苗,該納米乳劑裝載有編碼PMIF的自擴增mRNA。兩個15?g劑量可改善輔助性T細胞的發育,并誘發抗瘧原蟲IgG抗體和記憶性T細胞反應。
另一項關于瘧疾感染的機制研究發現,惡性瘧原蟲富含谷氨酸蛋白(PfGARP)是一種潛在的mRNA疫苗靶點。一種編碼PfGARP抗原的核苷修飾mRNA疫苗正在開發中,該疫苗使用了Acuitas Therapeutics專有的LNP。臨床前研究表明,該疫苗可以降低動物感染瘧原蟲后的反應。
本文轉載自:“藥時空”公眾號,如有侵權請聯系刪除
關于綠綿科技
北京綠綿科技有限公司(簡稱:綠綿科技)以體現客戶服務價值為宗旨,以專業精神和技能為廣大實驗室分析工作者提供樣品前處理、樣品制備及分析、實驗數據精確分析和管理的全面解決方案,致力于協助客戶提高分析檢測的效率和水平。主要代理產品聯系電話:010-82676061/2/3/4/5/6/7/8
E-mail:info@lumtech.com.cn。
