疫苗用mRNA遞送系統性能的決定因素


mRNA遞送系統性能的決定因素是多因素且相互作用的,包括:(1)它們遞送到適當細胞并有效釋放mRNA到細胞質翻譯機制的效力或能力;(2)它們的佐劑性,可增強免疫應答;(3)將注射部位過度炎癥或全身分布和脫靶表達可能引起的不良事件或毒性的任何作用降至低。
1、劑量
目前SARS-CoV-2臨床試驗正在追求的大范圍劑量(1-100μg)容易理解mRNA遞送系統的效力。
人體試驗中的劑量明確分為核苷修飾RNA(Moderna,BioNTech)較高的30-100μg劑量、未修飾RNA(CureVac,Translate Bio)較低的7.5-20μg劑量,甚至自我擴增RNA(Arcturus,倫敦帝國理工學院)較低的1-10μg劑量。
在確定這些劑量時,考慮兩個因素:中和抗體滴度水平和與恢復期血漿相比達到的T細胞應答,以及每個劑量下發生的不良事件的頻率和嚴重程度。
似乎存在一個相當窄的接受窗口,其中達到保護作用所需的劑量也接近于產生不可接受的頻率和嚴重程度的不良事件的劑量,即所有i期臨床試驗中試驗停藥的高劑量。
與恢復期血漿相比,在BioNTech 1期試驗中檢測的兩種改良核苷構建體具有較高的中和滴度,其中編碼膜結合全長刺突蛋白的較大構建體具有較低的不良事件頻率和嚴重程度,因此選擇其用于3期研究。
值得注意的是,劑量以質量表示,而摩爾劑量取決于結構的長度,此外,實際翻譯的mRNA量是其中的一小部分,取決于遞送系統的效率和靶向特性。
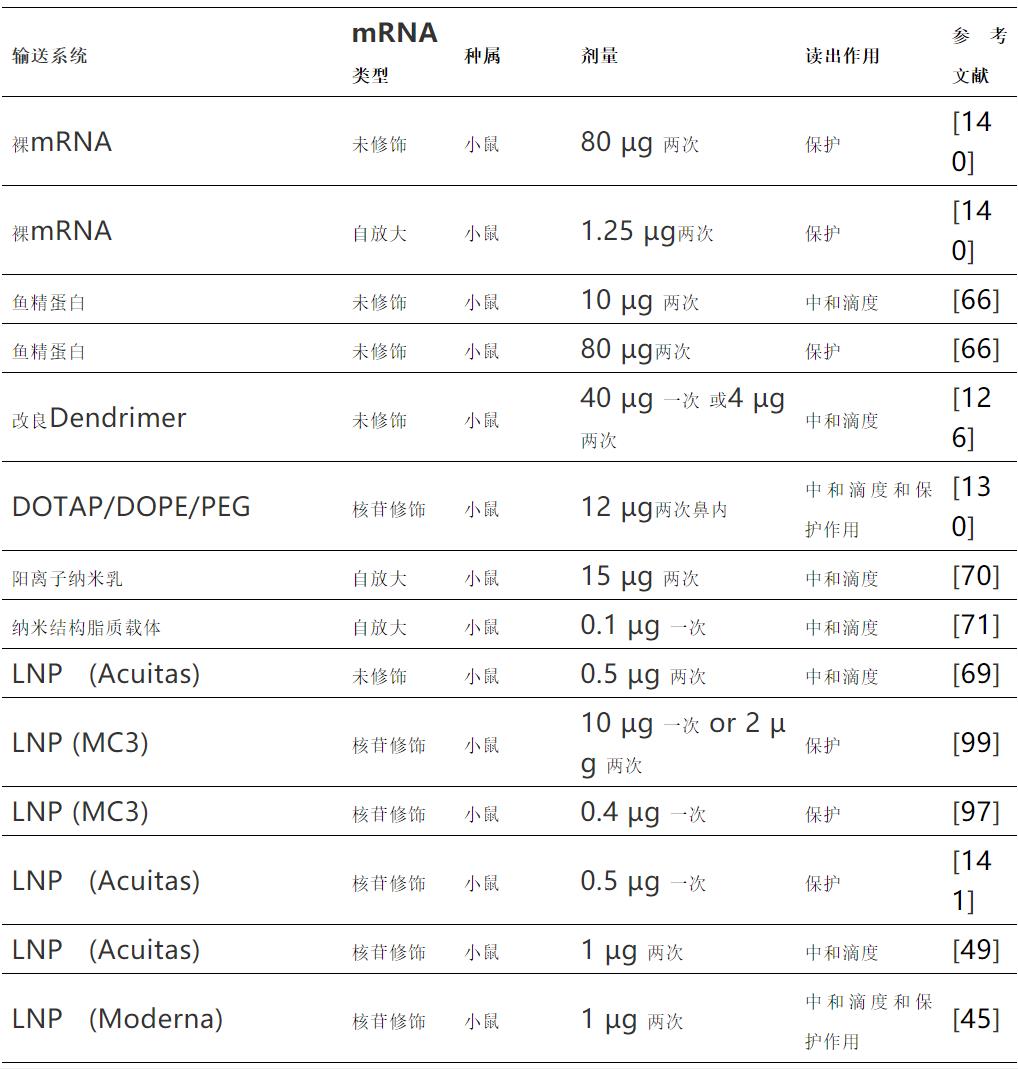
在感染性疾病的預防性mRNA疫苗的動物研究中,當使用魚精蛋白、樹狀大分子和早期陽離子脂質系統時,在小鼠體內的10-80μg范圍內初始劑量能夠產生相當高的中和抗體或免受病毒攻擊的保護能力。
當使用近的LNPs時,當給予兩次時,小鼠中和所需的劑量顯著降低到接近1μg水平,而對于未修飾的mRNA,劑量似乎較低,接近0.25μg。自我擴增mRNA的劑量可以更低,如0.1μg給藥兩次或2μg給藥一次。
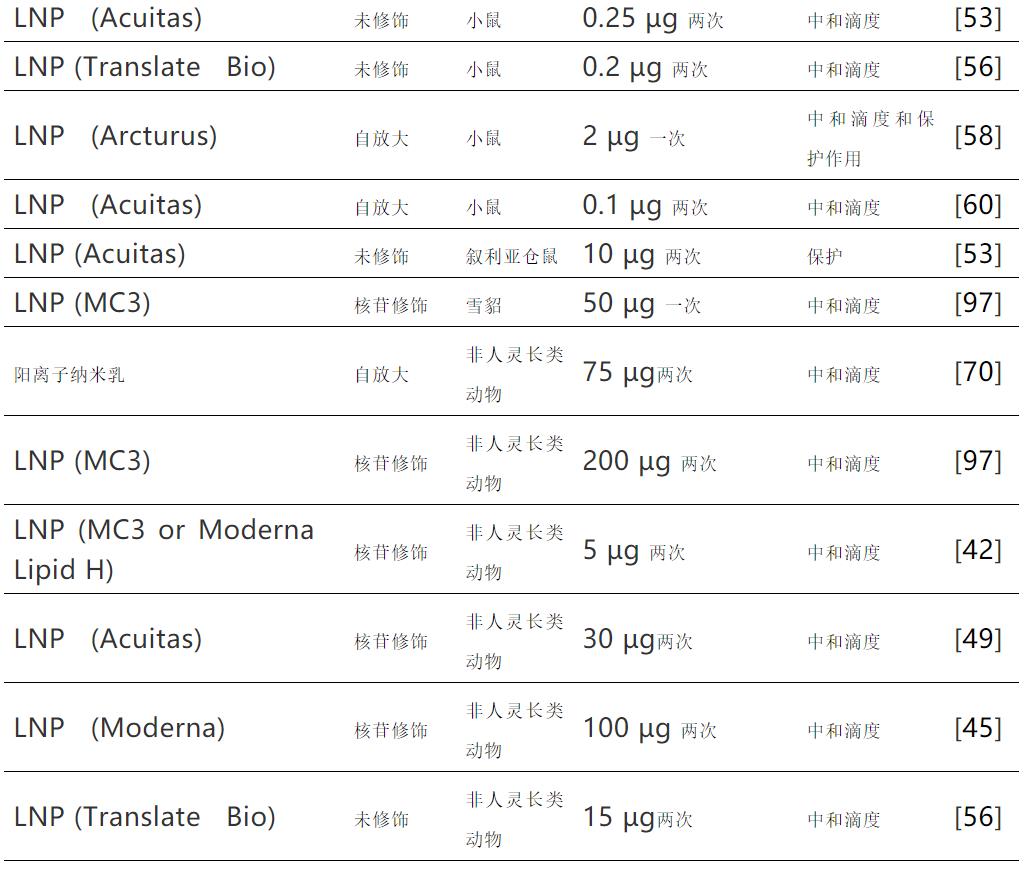
在較大的動物模型(倉鼠、雪貂和非人靈長類動物)中,有限的研究表明其劑量范圍較寬,為5μg至200μg,無明顯模式。有趣的是,當使用體表面積將人用劑量轉換為動物劑量時,60 kg人的100μg劑量相當于3 kg恒河猴的15μg劑量和20 g小鼠的0.4μg劑量。
人們強烈希望提高給藥效率,以降低劑量并維持效價,因為這有可能通過減少mRNA和給藥溶劑的局部反應和脫靶效應來降低不良事件頻率和嚴重程度。減少劑量還將降低所需原料的量和與每個個體接種相關的成本。
特別是,目前的COVID-19大流行使人們關注mRNA LNP疫苗的一些重大供應鏈和生產能力限制,可以用更高效的遞送系統來改善。
下表中體內預防性接種中的mRNA劑量顯示了不同mRNA遞送系統和不同種屬誘導中和抗體滴度所需的mRNA劑量,或提供病毒攻毒保護的劑量。與早期遞送系統相比,用于mRNA遞送的脂質納米顆粒(LNPs)的出現將所需劑量降低了約10倍。
2、效力和遞送效率
有許多研究試圖確定LNP和其他核酸遞送系統的結構-功能關系。LNP常被引用的決定其效力或遞送效率的特征是其pKa。
pKa是LNP中50%可電離脂質質子化的pH值。迄今為止,LNP pKa僅用稱為TNS的染料結合測定法測量,TNS帶負電荷,結合帶正電荷的LNP后出現熒光增強[88]。在覆蓋廣泛pH值范圍的緩沖液中與TNS孵育的LNPs的熒光測量用于推斷染料與表面電荷的結合,當出現大熒光的一半時,即得到pKa估計值。
眾所周知,基于MC3的Onpattro LNP在IV給藥后沉默肝細胞的佳pKa為6.4。對于任何能夠影響肝細胞沉默的LNP,其TNS pKa在6.2-6.8范圍內都有一個非常尖銳的佳值。
解釋這種pKa依賴性的極好模型是基于LNP中的可電離脂質在pH 7.4時接近中性,而內化進入細胞后,內涵體pH明顯下降,隨著內涵體途徑吞噬的推進,從而逐漸質子化可電離脂質,然后,它將與內涵體的陰離子內源性磷脂結合,并破壞其雙層結構,將mRNA釋放到細胞質中進行核糖體裝載。
內涵體破壞需要可電離脂質的額外特征,即脂質尾部橫截面大于其頭基的錐形形態。這使得可電離的脂質/內涵體磷脂離子對與雙層不相容,更可能形成可破壞內體膜的倒六角形相等結構。這被稱為分子形狀假說,解釋了為什么在飽和C18烷基鏈中引入一個或兩個雙鍵會產生更多的圓錐形和更少的圓柱形形態,即膜破壞和溶酶體溶解。
這兩個C18亞油酸尾,結合二甲胺頭基的適當調整pKa,是MC3可電離脂質的明確特征。替代MC3進行mRNA遞送的可電離脂質保留了pKa的需求,但通過在烷基尾部引入更多的分支來追求更大的內體溶解特性。
例如,Moderna的脂質H和脂質5具有三個烷基尾,Arcturus的脂質2,2(8,8)4 C CH3也是如此,而Acuitas ALC-0315具有四個烷基尾,A9具有五個烷基尾。這種增強的錐形形態可能是為什么包含這些可電離脂質的LNPs是更有效的遞送載體,具有更大的內體釋放的原因。
盡管LNP pKa和分子形狀假說被公認為有助于LNP遞送效率,但其他因素也很重要,如PEG–脂質在LNP表面的穩定性,以及乙醇溶液中4種脂質的比例,終決定了LNP超微結構。
如上所述,PEG–脂質通過提供親水性外殼控制LNP大小,限制組裝過程中的囊泡融合,使較高的PEG–脂質濃度產生較小的LNPs。例如,一項研究表明,PEG脂質的摩爾分數從0.25%變為5%可使LNP大小從117 nm減小至25 nm,肝細胞沉默的佳大小為78 nm,由2.5%PEG脂質生成。
由于PEG–脂質的烷基尾有14個碳,它沒有穩定地錨定在LNP表面,被發現在循環中從LNP逐漸脫落,同時可電離脂質MC3和DSPC的脫落。這種PEG脫落被認為在某個時間點使LNP有轉染能力,但是,如果太極端,導致可電離脂質和DSPC的快速丟失,這將對內體釋放產生負面影響。例如,通過將烷基尾延伸到18個碳,PEG–脂質沒有脫落,但在肝細胞中也沒有沉默。
另一方面,加入較高濃度的PEG使顆粒變小,導致更快的脫落,可電離脂質的損失和沉默減少。LNP的不穩定和動態性質目前只是部分了解。另一項研究還發現,與100 nm處的較大LNP(0.5%PEG-脂質)以及48 nm處的較小LNP(3%PEG-脂質)相比,用1.5%PEG-脂質制成的中等大小直徑64 nm的LNP對mRNA遞送更有效,與上述研究相似。
然而,通過改變四種脂質的摩爾比,在64 nm 1.5%PEG–脂質LNP中發現的佳值下保留LNP PEG層下DSPC的計算密度,這些研究者能夠制造更大的100 nm LNPs,與64 nm大小的LNPs相比,mRNA表達增加兩倍。因此,除了LNP pKa、可電離脂質分子形狀和PEG–脂質的動力學外,LNP超微結構的更詳細特征和各組分的狀態在確定效價方面也很重要。
3、內涵體釋放
另詳細研究了siRNA-LNPs的內體釋放細胞攝取和內體運輸,并假定與mRNA LNPs的攝取和內體運輸相似。
對于MC3 LNP,在電子顯微鏡下使用膠體金顆粒計數進行的定量研究表明,只有2%的內體siRNA實際上從內體逃逸到細胞質中,導致每個細胞有幾千個siRNA分子可用于沉默。
然而,這個數字與在治療相關濃度下每個細胞與RISC相互作用的功能活性siRNA的估計水平在相同的范圍內。因此,絕大多數siRNA注定會發生內體降解或通過多泡體(晚期內體)再循環,在外泌體中釋放。
增加LNPs的內體溶解行為是提高遞送效率的中心方法,主要是通過pKa調整LNP和通過增加可電離脂質的錐形形態。對于后者,Lipid H[42]和Lipid 5[101],在MC3中含有三個分支而在MC3中含有兩個分支,但具有相似的pKa,與MC3相比,內體釋放增加了4倍。Acuitas ALC-0315的內體釋放尚未見報道;但其肝細胞沉默效率是MC3的10倍,提示其更多的錐形四分支結構也具有更高的內體釋放。
因此,這些新一代的可電離脂質似乎實現了內體釋放,與MC3 siRNA-LNPs發現的2-5%相比,接近15%或更高。這方面的挑戰是缺乏一種可靠的標準化內體釋放方法,可以廣泛實施。已經開發了許多方法,但通常僅針對一個實驗室組。
近還發現mRNA發生胞吐作用的量與釋放到細胞質中的量相似[150]。MC3 LNPs在晚期內體和MC3的NP 1復合物中解體,mRNA被重新包裝成從細胞中輸出的外泌體。這些內-外泌體保持了與它們來源的原始MC3 LNPs相似的mRNA遞送能力,但可以運輸到不同的組織,似乎免疫激活較少。LNPs遞送的mRNA的這種外泌體再分布的潛在意義仍有待探索。
4、電荷和配體介導的靶向作用
早期的脂質納米顆粒使用永久帶電不可電離且很大的陽離子脂質,由于它們的永久正電荷,被迅速調理,一般靶向肺。
BioNTech的研究小組減少了DOTMA/DOPE mRNA LNPs中陽離子DOTMA的量,直到NP比率小于1時,陰離子mRNA過量導致凈電荷為負電荷。靜脈注射這些帶負電荷的300 nm大的mRNA LNPs后,產生脾臟靶向作用,樹突狀細胞中的mRNA表達,它們能夠介導腫瘤免疫治療的適應性以及I型IFN介導的先天性免疫機制。
同樣,使用C12-200原型LNP產生脾臟靶向mRNA LNPs,但用小的樹突可電離脂質Cf-Deg-Lin替換C12-200,它具有4個亞油酸烷基鏈和4個氮原子,TNS pKa為5.7。LNP的這種非常低的pKa將確保可電離脂質在pH低于7時才被質子化,這種LNP可以承擔mRNA的凈負電荷,可一直維持到細胞內體途徑吞噬,因此類似地運輸到脾臟。
他們發現脾臟中表達mRNA的主要細胞群是B淋巴細胞,根據流式細胞分析,其中7%的B淋巴細胞表達mRNA。近,使用三種不同的堿性LNPs實現了電荷介導的靶向作用,MC3、C12-200或5A2-SC8作為可電離脂質混合在永久性陽離子脂質(DOTAP)或永久性陰離子脂質(18 Pa)的一定摩爾分數中,賦予LNPs凈正性,凈負電荷或中間近中性凈電荷。
與上述發現一致,高陽性LNPs靶向肺部,高陰性LNPs靶向脾臟,而中間電荷水平主要靶向肝臟。已證明肝臟靶向作用依賴于Apo-E與近中性脂質體或LNPs的結合,而帶負電荷的脂質體不會發生這種情況。
值得注意的是,上述所有電荷介導的靶向研究均使用IV給藥進行,尚未檢查通常用于疫苗接種的途徑,如肌內或皮內途徑。然而,大多數分析肌內注射后表達的研究確實檢測到mRNA LNPs的全身轉運,其在肝臟中快速和強烈表達,同時在肌肉和引流淋巴結中表達。
因此,這些特殊的LNPs似乎進入脈管系統,隨后由于被動的ApoE介導的靶向作用在肝細胞中表達,這并不奇怪,因為它們是為肝細胞靶向作用而設計的。然而,免疫原的這種全身分布和表達可能產生全身細胞因子、補體激活,并導致其他潛在的不良反應,可能放大不良事件的頻率或嚴重程度和/或損害免疫應答的產生。后,配體介導的LNPs靶向作用的研究數量有限。
通過將CD31(PECAM)抗體與LNP偶聯并血管內注射實現肺內皮細胞靶向。然后,肝臟中肝細胞導向的LNP大部分重定向至肺。使用VCAM配體的類似方法成功地將LNPs靶向大腦炎癥區域,并減輕TNF-α誘導的腦水腫。
使用甘露糖基化脂質體也可以更有效地轉染體外樹突狀細胞,這可能是一種適用于疫苗接種的策略。還開發了識別靶向特定細胞類型配體的高通量篩選方法,可能適用于靶向特定樹突狀細胞亞群。
5、脂質納米顆粒的佐劑性
脂質納米顆粒具有自身的佐劑活性。
一項在小鼠(10μg劑量)和非人靈長類動物(100μg劑量)中進行的核苷修飾mRNA LNPs(編碼各種免疫原)研究顯示,與滅活病毒相比,抗原特異性濾泡輔助性T細胞(Tfh)和生發中心B細胞(GC B)的數量增加。
Tfh細胞驅動免疫球蛋白類別轉換、親和力成熟以及長期B細胞記憶和漿細胞。當FLuc mRNA LNP與蛋白亞單位HA免疫原共同給藥時,發現了LNP本身的佐劑特性,生發中心B細胞數量增加了4倍,盡管與單獨蛋白相比,Tfh細胞的數量沒有增加。
因此,LNP似乎放大了GC B細胞的反應,特別是對核苷修飾的mRNA LNP。另一項研究使用來自默克的不對稱可電離脂質研究了LNPs作為乙型肝炎蛋白亞單位疫苗的佐劑。
LNPs與蛋白亞單位疫苗共同給藥增強了B細胞對與已知疫苗佐劑相當水平的反應,包括基于鋁的佐劑、寡核苷酸和TLR4激動劑、3-O-脫酰基單磷酰脂質a(MPL)。LNPs引起了強效的抗原特異性CD4 + 和CD8 + T細胞應答,Th1與Th2偏倚可能進一步受到LNP中包含額外佐劑的影響。該組使用登革病毒免疫原進行的后續研究發現,LNP中的佐劑活性同樣較強,且該活性取決于是否存在可電離脂質。
脂質體中的脂質組分之前也被認為在粘膜疫苗中具有佐劑活性。
6、mRNA LNPs的注射部位反應、安全性、耐受性、反應原性
在大鼠和非人靈長類動物中,對表達hEPO的MC3核苷修飾的mRNA LNPs進行靜脈注射給藥的一般安全性研究發現,劑量高達0.3 mg/kg時出現輕度毒理學事件,該劑量是預期治療劑量的10倍以上。
大鼠中的主要結果為白細胞計數增加、所有劑量下的凝血參數變化以及肝損傷。非人靈長類動物顯示淋巴細胞耗竭伴輕度和可逆的補體激活。這些結果與相同LNPs用于siRNA遞送的早期毒理學研究一致,其中在6 mg/kg時觀察到大鼠死亡,而無可見有害作用水平(NOAEL)確定為1 mg/kg。
觀察到血清生化參數(ALT、AST和TBIL)升高3 mg/kg以上、血尿以及肝臟(空泡形成、炎性細胞浸潤、纖維化、出血和肝細胞壞死)、脾臟(淋巴萎縮和壞死)和腎臟(腎小管變性/再生)的鏡檢結果。患者中的安全性結果包括輸注相關反應(15%的患者,推測為補體介導)和促炎性細胞因子一過性升高。
值得注意的是,上述IV給藥劑量(如0.3 mg/kg)比當前使用IM給藥的SARS-CoV-2臨床試驗高10倍以上。盡管如此,當前人體試驗中的這些較低劑量仍可誘導局部注射部位反應和全身不良事件的高頻率和有時中度嚴重程度。目前,關于這些動物中人類不良事件的相關性,發表的動物研究很少。
使用MC3 LNP進行廣泛的恒河猴研究,觀察注射部位和mRNA表達的轉運,以50μg劑量肌內或皮內注射核苷修飾的mRNA(編碼流感免疫原H10 mRNA)。他們發現4-24h內注射部位的細胞快速浸潤,可由LNP單獨驅動,主要由中性粒細胞和單核細胞組成。表達mRNA的主要細胞類型為注射部位和引流淋巴結中的多個單核細胞和樹突狀細胞亞群。
T細胞應答的啟動僅限于引流淋巴結,LNP單獨不能誘導抗原呈遞細胞的CD80。疫苗特異性CD4 + T細胞的持續生成僅發生在疫苗引流淋巴結中,其中mRNA編碼抗原的檢測在24h達到峰值,而抗體應答持續數周。使用編碼狂犬病病毒糖蛋白G(RABV-G)的非修飾mRNA,以Acuitas LNP遞送小鼠0.5-10μG劑量以及非人靈長類動物10μG和100μG劑量,也報告了與上述一致的結果。
他們還發現,LNP單獨介導了肌肉注射部位和引流淋巴結中的細胞因子生成,但需要認識到由于通過血液的運輸和在肝臟中的表達, 可以在系統中檢測到IL6。在10μg和100μg劑量下,在非人靈長類動物中均觀察到注射部位紅斑和水腫。
值得注意的是,mRNA遞送系統中使用的LNPs的尺寸范圍為10-100 nm,是淋巴管攝取的佳尺寸,脂質聚乙二醇化可改善淋巴管中的滯留。
自輝瑞/BioNTech疫苗的緊急使用批準以來,已觀察到數例急性過敏反應,相當于每100,000次疫苗接種中1例,約為其他疫苗的10倍。這種過敏反應的一個可能來源是抗PEG抗體在一般人群中的流行,由于在LNPs中使用PEG–脂質,這可能在患者亞組中觸發過敏反應。
已經觀察到PEG介導的過敏反應,例如,在臨床造影劑[171]和多柔比星脂質體制劑中。盡管如此,當前SARS-CoV-2疫苗的給藥劑量對應于PEG總劑量,比這些產品中發現的劑量低至少15倍,這似乎減少了這種可能性。
另一種可能是反應本質上是過敏樣反應,但是對炎癥和其他因素的非特異性反應。目前正在進行一項臨床研究,以進一步闡明該問題。
在過去的二十年里,mRNA療法的進展是非凡的,從使用改良核苷和序列工程來確定控制mRNA先天免疫原性的手段,以及mRNA在疫苗和其他治療適應癥中的應用開始。
與以前的系統相比,采用siRNA遞送中使用的脂質納米顆粒原型導致遞送效率提高了一個數量級,并在不斷改進,主要是由于設計了新類別的可電離脂質。mRNA LNP結構、功能、效力、靶向性和生物學特征的許多方面如佐劑性等,仍有待探索,以便充分開發這種強大和變革性治療方式的潛力。
參考文獻:Nanomaterial Delivery Systems for mRNA Vaccines,Published online 2021 Jan 19. doi: 10.3390/vaccines9010065
文章來源:藥啟程公眾號
關于綠綿科技
北京綠綿科技有限公司(簡稱:綠綿科技)以體現客戶服務價值為宗旨,以專業精神和技能為廣大實驗室分析工作者提供樣品前處理、樣品制備及分析、實驗數據精確分析和管理的全面解決方案,致力于協助客戶提高分析檢測的效率和水平。主要代理產品聯系電話:010-82676061/2/3/4/5/6/7/8
E-mail:info@lumtech.com.cn。
