mRNA癌癥疫苗按下加速鍵,國內企業“比學趕超”進展如何?

從1960年mRNA首次被成功提取,60多年后通過改造mRNA得到具有劃時代意義的mRNA新冠疫苗,mRNA技術才真正發揮巨大作用。要不是因為一位女科學家的堅持,這項技術或許還要很久才會被關注。
不過,雖然以疫苗產品聞名,但mRNA技術的未來遠不止于此。今年10月,BioNTech的兩位創始人在接受BBC采訪時表示,基于mRNA疫苗技術路線的癌癥疫苗研究已經取得了突破,有望于2030年前問世。如果mRNA技術發展能夠順利,那么人類離治愈癌癥可能不遠了。

一、從邊緣到舞臺中央
1985年,匈牙利生物研究員卡塔琳·卡里科因遲遲沒有研究成果而被匈牙利科學院生物研究中心解雇。癡情于mRNA的她原本想在歐洲找到一份繼續研究的工作,卻接連遭遇挫敗。無奈之下,卡塔琳·卡里科轉戰美國,卻仍然屢屢碰壁。
1995年,由于持續性地無法申請到項目基金,在賓夕法尼亞工作六年后的卡塔林·卡里科被降職,錯失成為該校全職教授的機會。直至1997年加入同樣堅信mRNA技術的免疫學家德魯·魏斯曼的團隊,卡塔林·卡里科的研究才開始出現轉機。

德魯·魏斯曼(Drew Weissman)和卡塔林·卡里科(Katalin Karikó),來源:參考資料1
在卡塔林·卡里科之前的研究過程遇到的最大的瓶頸是,不管是天然RNA還是在體外人工合成的RNA,都會毫無例外地激活人體免疫細胞的反應,從而導致RNA還沒來得及被翻譯成蛋白質就降解了。2005年在德魯·魏斯曼的協助下,卡塔林·卡里科發現對RNA組成成分之一的尿苷修飾后的mRNA都可逃避免疫傳感器的信號識別,從而解決了RNA應用研究中最大的難題。這一突破性的研究發表在了Immunity雜志上,這也標志著RNA療法的誕生。
2007年,哈佛大學醫學院的助理教授德里克·羅西通過使用卡塔林·卡里科和德魯·魏斯曼修飾mRNA尿苷的方法在干細胞上進行RNA的應用研究,嘗試將體細胞重編程為胚胎樣干細胞。在經過一年多的探索后,他們成功了。2010年,這一研究被《時代》雜志評為當年的十大醫學突破之一。
很快,德里克·羅西便成立了Moderna公司。
在德國,一對土耳其科學家夫妻烏古爾·薩欣和奧茲朗·圖雷利早早就關注到了卡塔林·卡里科和德魯·魏斯曼的研究,也迅速地創立了基于mRNA療法的生物技術公司——BioNTech。

BioNTech創始人烏古爾·薩欣和奧茲朗·圖雷利來源:參考資料4
往后的故事,大家都已經耳熟能詳。疫情之下,mRNA疫苗成為全球最大的醫藥品類。2021年,BioNTech的BNT162b2疫苗和Moderna的mRNA-1273疫苗分別創下404億美元和176.75億美元的營收,成為全球銷售額第一和第三的醫療產品。
然而,mRNA疫苗治療癌癥仍然面臨很多挑戰,比如識別腫瘤特異性表位仍然是一個長期需要探索的問題,比如如何驗證最可行的給藥方式等。
二、必須突破的挑戰
mRNA癌癥疫苗可分為兩類,包括基于樹突狀細胞(DC)給藥的mRNA疫苗和直接注射的mRNA疫苗。
DC疫苗通過體外轉錄獲得mRNA,轉染至DC后,mRNA在細胞質中翻譯形成抗原從而激活DC,將激活的DC注入人體以激發免疫系統應答,達到殺死腫瘤細胞的目的;直接注射的mRNA疫苗則是以粒細胞-巨噬細胞集落刺激因子(GM-CSF)作為佐劑,將編碼相關抗原的mRNA注射入患者體內,從而刺激機體產生抗體,抑制腫瘤細胞生長。
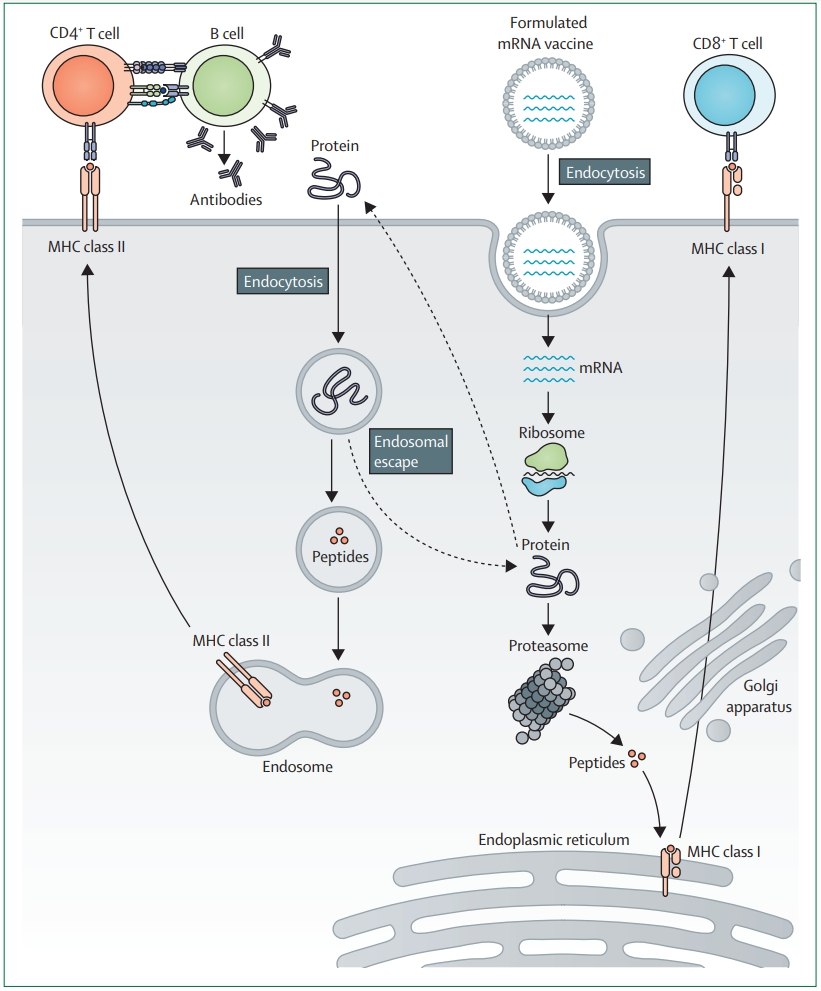
基于mRNA的疫苗作用模式來源:參考資料3
1996年,第一個基于mRNA的癌癥疫苗研究首先在DC中進行了體外實驗。如今,科學技術的進步使mRNA的結構、穩定性、注射方式得到多方面優化。mRNA可以通過皮內、皮下、鼻內、結節內、肌肉內、瘤內和靜脈注射等方式進行給藥。如何將其成功的遞送到人體成了mRNA技術發展的最大挑戰。
mRNA由單鏈構成,很容易在人體內發生降解;同時,mRNA想要實現翻譯功能必須進入到細胞膜內,但由于mRNA和細胞膜均帶負電荷,會產生排斥反應,導致mRNA難以進入。受這些因素阻礙,即使mRNA不會引起免疫反應,但仍難以起到安全穩定的治療目的。
為了促進細胞對mRNA的攝取,科學家開始嘗試利用遞送系統來輔助。為了提高遞送效率并盡可能降低治療副作用,研究者開發了多種包裹mRNA的遞送載體。遞送mRNA疫苗的手段有物理方法、病毒載體方法和非病毒載體方法。脂質體及其衍生物已成為目前遞送mRNA最有效的非病毒載體。用于遞送mRNA疫苗的脂質載體主要分為以下幾種:脂質體復合物(LP);脂質體聚合物(LPR);脂質體納米粒(LNP);陽離子納米乳(CNE)。
目前三種mRNA新冠疫苗均采用了LNP遞送系統。
LNP通常包括四種成分,可電離脂質/可離子化脂質、膽固醇、輔助磷脂/中性脂質、PEG修飾脂質,它們共同封裝和保護脆弱的mRNA。不同分子及構成比例是各家LNP系統的主要差異所在。
但以LNP為載體制備的mRNA制劑會在肝臟及脾臟聚集,難以靶向其他部位,并易發生滲漏,在很大程度上限制其作為藥物載體的應用。行業也正在探索脂質復合物、多聚體等新型遞送載體。
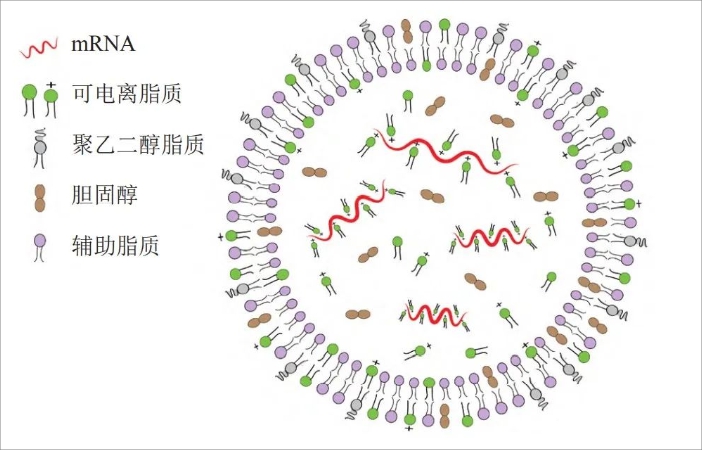
LNP遞送載體結構,來源:https://www.cn-healthcare.com/articlewm/20220620/content-1385362.html
聚合物和聚合物納米顆粒臨床進展不如LNP,但聚合物具有與脂質相似的優勢,能夠有效傳遞mRNA,陽離子聚合物將核酸濃縮成具有不同形狀和大小的復合物,可通過內吞作用進入細胞。
聚乙烯亞胺是研究最廣泛的核酸傳遞聚合物,盡管其功效卓越,但由于其高電荷密度以及毒性限制了應用。
新型含脂聚合物電荷改變可釋放轉運體(CARTs)能有效地靶向T細胞,操縱T細胞是非常困難的,因此,CART是一種極具吸引力的傳遞材料,在mRNA疫苗和基因治療領域具有巨大潛力。
多肽也可以將mRNA傳遞到細胞中,這要歸功于其主鏈和側鏈中的陽離子或兩親胺基,這些陽離子或兩親胺基與mRNA靜電結合并形成納米復合物。
角鯊烯陽離子納米乳液也可以傳遞mRNA,這些納米乳劑由油性角鯊烯核組成,不過角鯊烯基陽離子納米乳劑從內涵體逃逸并將mRNA輸送到細胞質中的機制尚不清楚。
有了這些日漸成熟的遞送技術,mRNA癌癥疫苗開發到什么程度了?
三、巨頭時代來臨
實際上,mRNA三大巨頭BioNTech、Moderna、CureVac以及國內的一些mRNA企業,早在開發新冠疫苗之前,主要都將治療性的癌癥疫苗作為各自mRNA技術的核心項目進行推進。
從研發現狀來看,mRNA疫苗已被廣泛嘗試應用于包括前列腺癌、急性骨髓白血病、轉移黑色素瘤、成神經細胞瘤等多種類型腫瘤的治療研究。
據統計,BioNTech擁有超過30個產品管線,腫瘤相關的約15個,其正在開發針對直腸癌、黑色素瘤和其他癌癥類型的治療方法。其中針對晚期黑色素瘤和HPV16陽性頭頸癌的BNT111和BNT113產品已經進入臨床II期,針對病人來源特異性抗原的個性化癌癥疫苗BNT122也已經進入臨床I、II期。2021年11月,BioNTech發布公告宣布美國FDA授予了其mRNA癌癥疫苗BNT111快速通道資格。

BioNTech部分mRNA研發管線
來源:BioNTech官網
Moderna同樣處于競速中。Moderna目前產品線合計超過45個,與腫瘤相關的約5個。其中有一款個性化的癌癥疫苗mRNA-4157,能夠容納高達34個編碼新抗原的mRNA序列,針對多個癌種,在臨床I期的疾病控制率達到了90%,目前正在進行臨床II期試驗。
今年10月,Moderna宣布與默沙東合作,將聯合開發并銷售一種個性化精準治療癌癥疫苗,推動Moderna的mRNA技術與默沙東PD-1 Keytruda聯用,探索治療高危黑色素瘤患者。目前,該項目處于臨床試驗II期,共招募了157例受試者。
CureVac專注于開發針對腫瘤、罕見病和傳染性疾病的mRNA療法,已有14個候選藥物,其中9款候選藥物已經進入了臨床階段。其中,CV-8102是一款基于RNA的單鏈非編碼TLR-7/8和RIG-1激動劑,早在2017年就已開展了I期臨床研究,用于晚期黑色素瘤、皮膚鱗狀細胞癌、頭頸部鱗狀細胞癌或腺樣囊性癌患者的治療。
但是目前全球范圍內大部分mRNA癌癥疫苗管線的研發都還處于較早階段,基礎性研究也尚未完全成熟,中國企業還是有很大的機會實現彎道超車。
四、能否彎道超車?
2022年11月11日,中國科學院國家納米科學中心王海研究團隊在Advanced Functional Materials期刊發表了一篇研究論文。該研究開發了一種水凝膠-LNPs系統(HA-mRLNPs),可以有效地將編碼腫瘤抗原的mRNA遞送到樹突狀細胞進行抗原呈遞,誘導抗原特異性CD8+T細胞殺傷腫瘤細胞,而且可在室溫下儲存。該研究證明穩定和持久免疫水凝膠-LNPs體系可用于有效的腫瘤免疫治療。
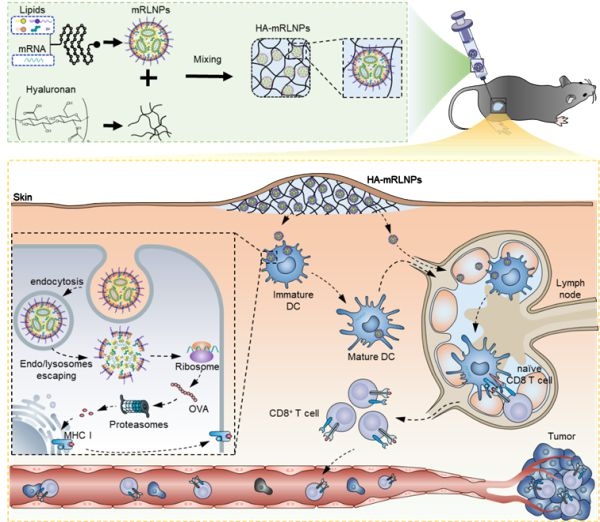
水凝膠-LNPs系統制備和體內腫瘤免疫示意圖
來源:參考資料7
這項研究的出現也證明了我國完全有能力在mRNA的基礎性研究中取得突破。
據不完全統計,我國專注mRNA技術開發的至少有26家,這一數量正在急劇增加。其中實力領先且臨床試驗進度靠前的公司包括艾博生物、斯微生物、麗凡達/艾美疫苗、深信生物、堯唐生物、嘉晨西海、瑞吉生物、藍鵲生物等。
艾博生物成立于2019年,擁有業界領先并具有自主知識產權的mRNA和納米遞送技術平臺,自主研發的動態精準混合技術可適用于納米脂球的工業化生產。目前進展最快的一款mRNA疫苗為艾博生物聯合沃森生物、軍事科學院醫學研究院共同研發mRNA新冠疫苗ARCoV,已于2022年9月獲印度尼西亞食品藥品監督管理局(BPOM)頒發緊急用途許可證,這是艾博生物在海外獲得的第一個EUA,也是中國首款在國際上獲批的mRNA疫苗。
不過目前艾博生物研發管線中主要為預防性病毒疫苗,尚未見到布局mRNA癌癥疫苗進入臨床階段。但在艾博生物的公開介紹中表示,癌癥疫苗是艾博生物在腫瘤領域產品開發的一個最為重要、也是目前項目占比最大的方向。
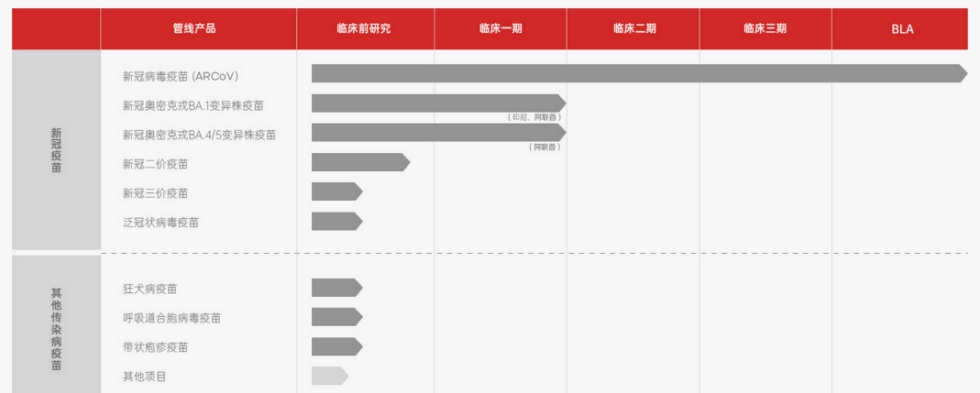
艾博生物研發管線來源:艾博生物官網
斯微生物2016年5月成立于上海張江,2017年獲得休斯頓衛理會醫院授權LPP遞送平臺全球獨家商業化權益,2018年建成mRNA生產中心,完成mRNA合成平臺驗證、納米制劑產業化生產驗證。今年10月,斯微生物宣布其自主研發的mRNA新冠疫苗三期臨床試驗已在老撾正式啟動。關于癌癥疫苗的研發進展,斯微生物透露,目前其mRNA個性化癌癥疫苗已在澳大利亞開展I期臨床,這是國內第一家進入臨床的個性化癌癥疫苗。
嘉晨西海成立于2019年,是國內mRNA行業中工業經驗尤其是CMC方面經驗領先的一家公司,管線涵蓋腫瘤免疫治療、傳染病疫苗、罕見病和醫學美容,其中自復制mRNA癌癥疫苗項目JCXH-211和JCXH-212分別在美國和中國進行I/II期臨床試驗。
總的來看,國內的mRNA癌癥疫苗領域從數量來講還不能構成競爭關系,更多的是在共同推動mRNA癌癥疫苗的應用與發展,處于努力把管線推進到臨床應用的初始階段。而一些國內Big Pharma的入場支持,如石藥集團等,或許更多的只是看中mRNA新冠疫苗的短期收益,而非真正想要投入mRNA技術的發展。
結語
未來,mRNA技術在癌癥疫苗研發方面的成果是非常值得期待的,新冠疫情給了mRNA一次千載難逢的機會,在行業領先者們獲得巨大的收益后,對mRNA的投入也將會史無前例。假設2030年便能看到mRNA癌癥疫苗的成果,那將是人類醫療史上最偉大的時刻之一。
國內在mRNA技術的發展中,切忌目光短淺,mRNA并非只有做新冠疫苗才是唯一出路。只有真正投入到基礎性的研究中去,才有實現彎道超車的可能。但很遺憾,目前國內無論Biotech還是Big Pharma當下的重心都不在此,如果不盡力彌補技術上的差距,就算mRNA的下一個風口來了,國內企業也很難把握得住。后續發展如何,作者還將持續關注。
參考資料
1、《十年磨一劍:mRNA疫苗誕生史》,生物世界,2021-1-27
2、《用于腫瘤&罕見病治療的mRNA藥物有哪些?》,藥投圈,2020-12-16
3、《柳葉刀綜述:mRNA癌癥疫苗的遞送及臨床進展》,金斯瑞生物官微,2022-11-7
4、《癌癥疫苗即將問世:能否一針清除癌細胞?哪些藥企在布局?》,澎湃,2022-10-18
5、《癌癥疫苗8年內面世?mRNA強在哪,國內藥企回應最新進展》,新浪財經,2022-10-18
6、《mRNA疫苗行業分析報告》,佰傲谷,2022-10-27
7、《國家納米中心王海團隊在腫瘤納米疫苗中取得新突破》,生物世界,2022-11-23
【聲明】本文觀點僅代表作者本人,不代表公眾號立場,歡迎交流補充
作者黃仲平
來源于美柏醫健
關于綠綿科技
北京綠綿科技有限公司(簡稱:綠綿科技)以體現客戶服務價值為宗旨,以專業精神和技能為廣大實驗室分析工作者提供樣品前處理、樣品制備及分析、實驗數據精確分析和管理的全面解決方案,致力于協助客戶提高分析檢測的效率和水平。主要代理產品聯系電話:010-82676061/2/3/4/5/6/7/8
E-mail:info@lumtech.com.cn。
