遺傳性失明患者新希望!LNP首次成功靶向感光細胞

過去幾年間,在新冠疫情全球蔓延的背景之下,基于 mRNA 構建起的強大遞送技術成為眾人矚目的焦點,其憑借優秀的臨床有效性和快速響應的能力在生物醫藥領域掀起一陣熱潮。近日,基于 mRNA 與脂質納米顆粒(LNP)載體技術,一種新的基因療法可能為遺傳性視網膜疾病(IRD)患者帶來更多選擇。
1 月 11 日,來自美國俄勒岡州立大學和俄勒岡健康與科學大學(OHSU)的一組研究人員在 Science Advances 期刊發布了一項最新研究。研究團隊成功發現了一種能夠靶向眼內光感受器(PR)的肽序列,通過將其與脂質納米顆粒結合,新的 LNP 遞送系統首次成功靶向動物的眼內感光細胞,并將 mRNA 遞送至小鼠以及非人類靈長類動物的神經視網膜中。

“當前研究已經發現,至少存在超過 250 種的基因突變與遺傳性視網膜疾病有關,但目前只有一種基因療法獲得批準。因此,針對一些早期的基因治療技術進行改進可以提供更多的治療選擇。”該研究的共同作者、來自 OHSU 醫學院的眼科助理教授兼 Casey 眼科研究所科學家 Renee Ryals 表示,“此次研究結果表明,脂質納米顆粒可以幫助我們做到這一點。”
首次成功靶向動物眼內光感受器
遺傳性視網膜疾病(IRD)是一組由遺傳因素引起的視網膜疾病的統稱。該類疾病可由與視網膜病理學相關的 300 余種不同的基因突變引起,這些基因的正確表達對于光感受器(PR)和視網膜色素上皮(RPE)功能而言至關重要。一旦這些基因不能正確表達,就會導致進行性的細胞死亡從而使患者失明。
對于該類遺傳疾病而言,最理想、最有效的治療方式莫過于通過基因增強、編輯或沉默等技術糾正致病基因。然而在此前研究中,由 LNP 介導的 mRNA 遞送僅限于視網膜色素上皮細胞(RPE)和 Müller 膠質細胞。無論是通過視網膜下還是玻璃體內遞送,LNP 都無法穿透神經視網膜,這就成為了它們將基因或基因編輯器遞送至光感受器(PR),也是最重要的細胞靶標之一的重要阻礙。
在本次研究中,研究團隊克服了此前使用脂質納米顆粒(LNP)遞送遺傳物質的主要限制——讓它們到達眼睛后部,也就是視網膜所在的位置。經過改良的脂質納米顆粒能夠穿透神經視網膜并將 mRNA 傳遞給感光細胞,從而恢復感光細胞的正常功能。
對此,科學家首先使用一個基于 M13 噬菌體的七聚體肽文本庫來鑒定出能夠在體內結合到神經視網膜的肽序列,然后使用篩選出的化學合成肽對于 LNP 遞送載體進行修飾。將經過 TAMRA 染料標記的肽配體 LNP 注射在小鼠的玻璃體內之后,能夠在視網膜中觀察到 TAMRA 染料。在此之后,進一步確定攜帶 0.15% 和 0.3% 的肽配體 LNP 具有最佳的 mRNA 遞送效果。結果表明,該遞送系統成功定位并且能夠將治療性 mRNA 遞送至小鼠的光感受器(PR)、視網膜色素上皮細胞(RPE)和 Müller 神經膠質細胞。
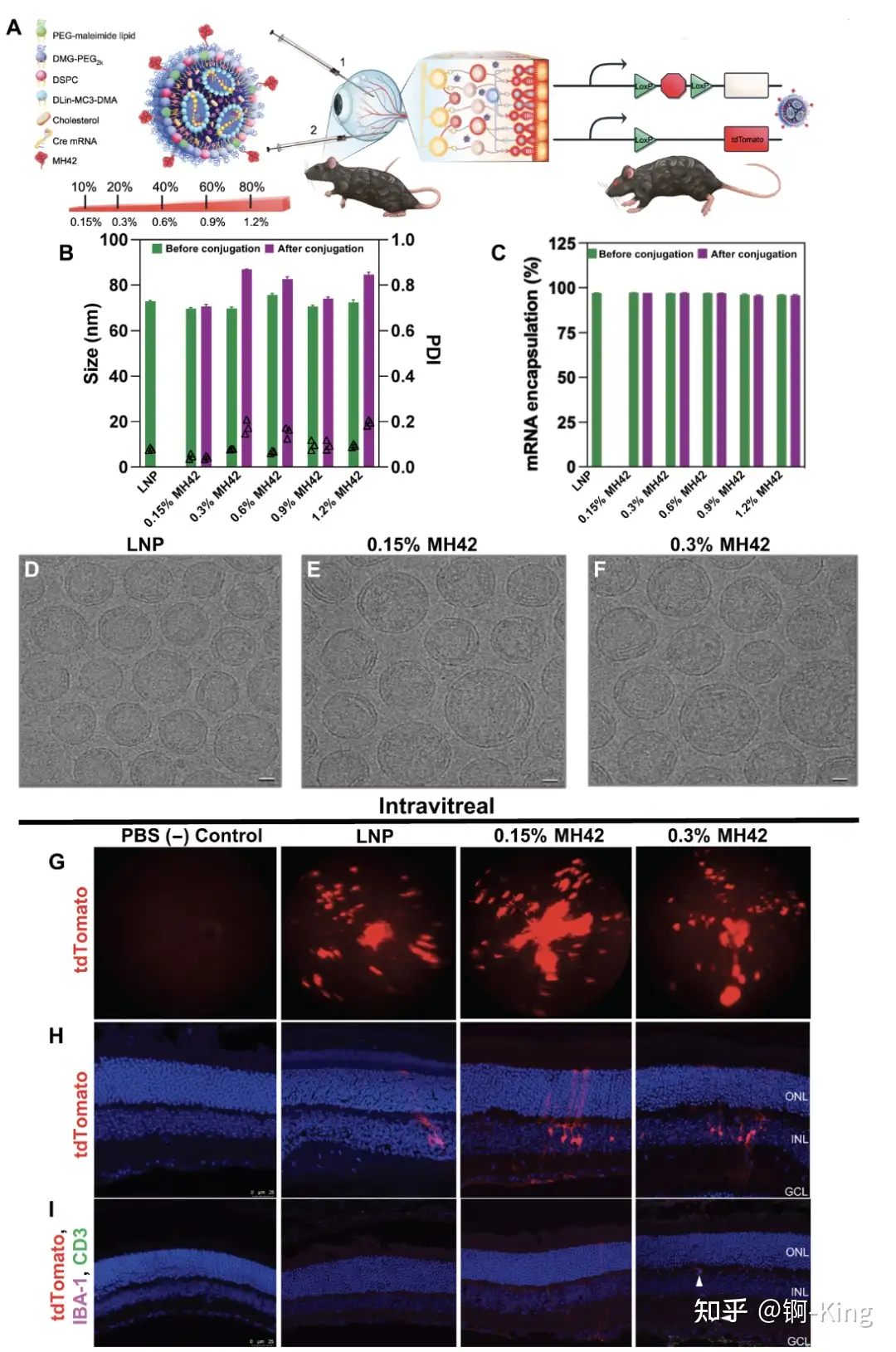
在此之后,研究團隊分別向小鼠和恒河猴的眼睛中進行注射治療。通過多種成像技術檢查發現,受試動物的視網膜組織發出綠色熒光,這表明脂質納米顆粒確實到達了光感受器,并且其遞送的 mRNA 成功進入視網膜并且產生了綠色熒光蛋白。上述結果表明,脂質納米顆粒能夠在非人類靈長類動物中靶向光感受器,這代表了 LNP-mRNA 遞送技術的一項新的突破。
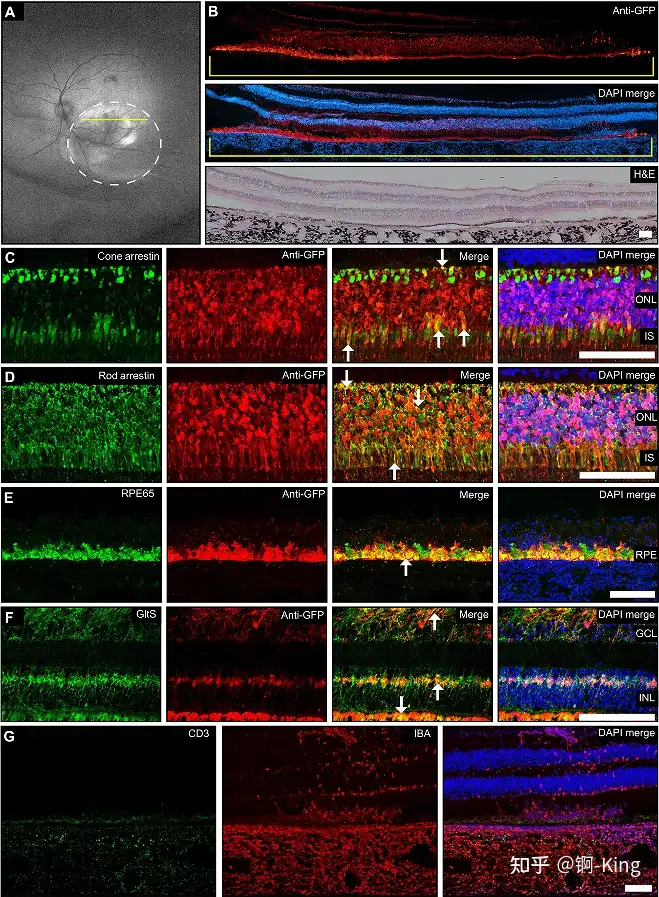
總體而言,本次研究確定了一種使用肽綴合的 LNP,通過該遞送系統能夠向神經視網膜靶向遞送 mRNA。與此同時,在非人靈長類動物獲得的積極試驗結果將具備更富前景的臨床轉化潛能。
“我們發現了一組可以到達眼睛后部的新型肽,這些肽就像一個郵政編碼,而脂質納米粒子類似于一個信封,我們可以像發送郵件一樣‘發送’基因療法,”該研究的通訊作者、俄勒岡州立大學藥學院副教授 Gaurav Sahay 博士解釋道,“這種肽能夠確保將 mRNA 精確地輸送到光感受器——直到現在才能夠用脂質納米顆粒靶向的細胞。”
使用 LNP 替代 AAV,解決應用限制難題
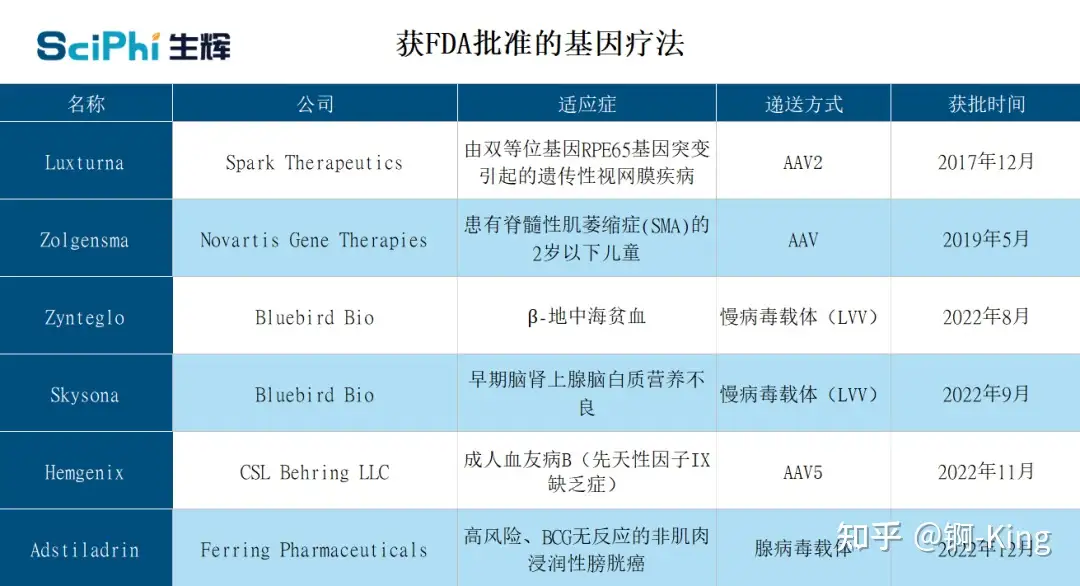
事實上,早在 2017 年,美國 FDA 已經批準了首個用于治療由雙等位基因 RPE65 突變引起的遺傳性視網膜疾病的基因療法 Luxturna(voretigene neparvovec-rzyl)。
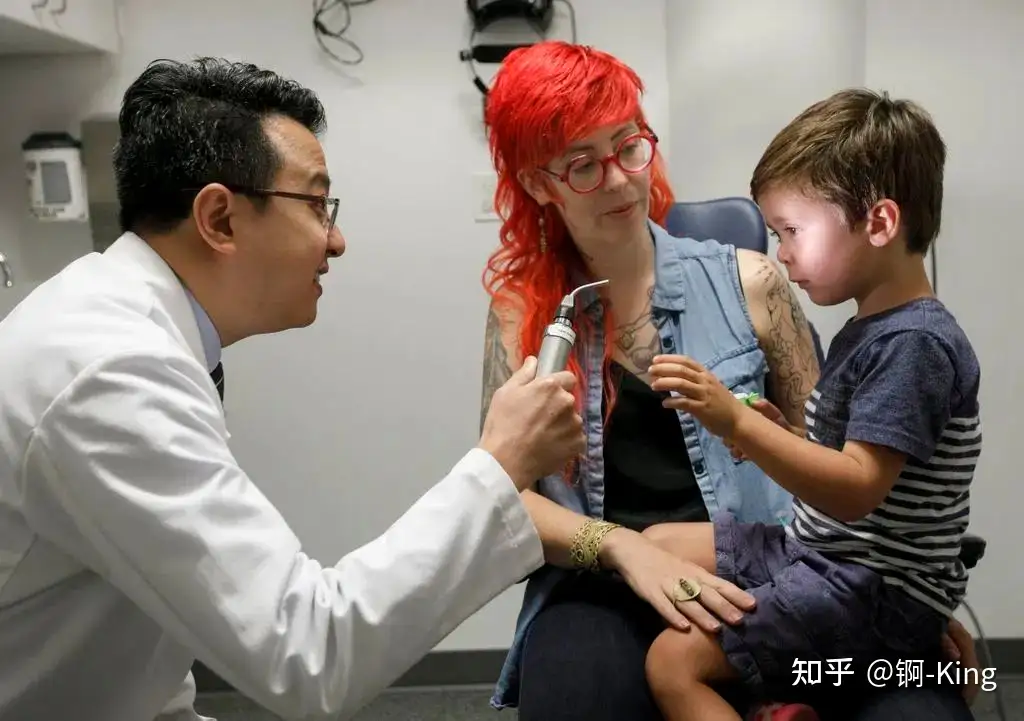
Luxturna 由基因療法制造商 Spark Therapeutics 開發,該療法使用腺相關病毒載體(AAV2),將 RPE65 基因的正常拷貝傳遞至視網膜色素上皮細胞(RPE)。Luxturna 獲批之后,來自美國俄勒岡州的一名 4 歲男童 Caspian 在 OHSU 的 Casey 眼科研究所接受了治療。在第一次手術后僅僅兩周,Caspian 的父母就發現他的視力已經有所改善,并且能夠參觀博物館,甚至能夠看到夜空中飛過的閃爍的飛機。
不可否認的是,AAV 遞送系統促進了針對視網膜疾病開展基因編輯治療的有效進展。在 Luxturna 之后,陸續又有 5 項基因療法產品獲得了 FDA 批準,并且這些療法均是基于腺病毒載體、慢病毒載體和 AAV 載體構建。然而 Sahay 和 Ryals 認為,該類遞送系統仍然存在較大局限性,因此積極開展了基于 LNP 遞送系統的基因療法開發工作。
Sahay 解釋道,“與 LNP 相比,AAV 的包裝能力十分有限,并且具備一定的免疫原性。除此之外,它對于編輯工具 Cas9 核酸酶的表達也表現不佳。這些問題突出了開發下一代視網膜基因傳遞載體的迫切需要,我們希望利用自身對于 LNPs 的了解來開發一種改進的基因編輯器傳遞系統。”
LNP 不僅在安全性方面獲得了臨床上的一致認可,其模塊化的系統也能夠允許封裝更大尺寸的療法序列。并且其作為一種合成的可生物降解的化學物質,能夠有效降低體內發生的免疫反應。
目前,Sahay 和 Ryals 的團隊已經從美國國家眼科研究所獲得了 320 萬美元的資金,用于繼續研究脂質納米顆粒在治療遺傳性失明方面的前景。他們將基于 LNP 提供一種新的基因編輯工具,從而刪除感光細胞中的致病基因并將其替換成為功能正常的基因。
研究團隊指出,“我們的長期目標是為 IRD 開發相應的 LNP 基因編輯療法平臺。理想情況下,基因編輯器將以 mRNA 的形式提供,并且通過核酸酶的穩定和瞬時表達,以減輕脫靶效應。”
文章來源:生輝公眾號,如有侵權請聯系刪除
關于綠綿科技
北京綠綿科技有限公司(簡稱:綠綿科技)以體現客戶服務價值為宗旨,以專業精神和技能為廣大實驗室分析工作者提供樣品前處理、樣品制備及分析、實驗數據精確分析和管理的全面解決方案,致力于協助客戶提高分析檢測的效率和水平。主要代理產品聯系電話:010-82676061/2/3/4/5/6/7/8
E-mail:info@lumtech.com.cn。
